الكيمياء الكهربائية
تدرس الكيمياء الكهربائية العلاقة بين الكهرباء والتغيرات الكيميائية التي تؤدي إلى توليد الطاقة الكهربائية. تُستخدم هذه التفاعلات بشكل رئيسي في البطاريات وخلايا الوقود، حيث تُحول الطاقة الكيميائية إلى كهربائية.
كما يمكن إنتاج تفاعلات كيميائية غير تلقائية عبر استخدام التيار الكهربائي في عملية تُسمى التحليل الكهربائي، حيث تتحول الطاقة الكهربائية إلى طاقة كيميائية يتم تخزينها في المواد الناتجة عن التفاعل.
هذه الطريقة شائعة في تطبيقات مثل تكرير المعادن، الطلاء الكهربائي، وإنتاج الهيدروجين والأكسجين من الماء. بالإضافة، يتم توليد الكهرباء أيضاً عبر حركة الإلكترونات بين العناصر في تفاعلات الأكسدة والاختزال.

طرق إنتاج الكيمياء الكهربائية
في مجال الكيمياء، تُعرف العمليات التي تضمن استخدام أو توليد الكهرباء بأنها تفاعلات كهروكيميائية. هذه التفاعلات تُقسم إلى نوعين رئيسيين: أولًا، التحليل الكهربائي، الذي ينطوي على فصل المركبات كيميائيًا بواسطة الكهرباء. ثانيًا، تحويل الطاقة الكيميائية إلى كهربائية من خلال تفاعلات الأكسدة والاختزال التي تحدث بشكل طبيعي.
كيفية إنتاج الكيمياء الكهربائية؟
يتم توليد الطاقة الكهربائية من عمليات كيميائية تحدث عند انتقال الإلكترونات بين العناصر المختلفة، خاصة خلال تفاعلات الأكسدة والاختزال. هذه التفاعلات تكون مرتبطة فيما بينها بواسطة تيار كهربائي يتدفق خارجياً، بالإضافة إلى وجود كهرل، وهو محلول يحتوي على أيونات قادرة على التحرك بحرية. الهدف من الكيمياء الكهربائية هو دراسة هذه التفاعلات وتأثيراتها على انتقال الشحنات وتوزيعها سواء في البيئات المتجانسة أو غير المتجانسة.
تطبيقات الكهرباء الكيميائية
تستثمر الكهرباء الكيميائية في العديد من الميادين، وفيما يلي بعض من أبرز تطبيقاتها:
في المجال الإلكتروني، تعتبر البطاريات مثالًا رئيسيًا حيث تعمل على تحويل الطاقة الكيميائية المخزنة إلى طاقة كهربائية وذلك في العديد من الأجهزة كالهواتف المحمولة، السيارات والألعاب الإلكترونية.
تلعب الطاقة الكهربائية الكيميائية دورًا مهمًا في مكافحة الصدأ والتآكل، حيث تساعد الاختبارات الكهروكيميائية في قياس وتقييم مدى تأثر المعادن بالصدأ وتطوير حلول للحماية منه.
وفي صناعة الإلكترونيات والمجوهرات، تستخدم عملية الترسيب الكهربي لطلاء أسطح المعادن بطبقات من معادن أخرى لتحسين مقاومتها أو لأغراض جمالية.
تستخدم المجسات الكهروكيميائية في العديد من التحليلات مثل الكشف عن مركبات معينة في الأغذية والبيئة، وكذلك في الأبحاث الطبية لقياس تركيز المواد الكيميائية في العينات.
أما خلايا الوقود، فتعد من الأدوات الفعالة في تحويل الطاقة من كيميائية إلى كهرباغة باحترافية عالية، وهي تسهم في توليد الكهرباء بطريقة صديقة للبيئة.
أنواع الخلية الكهروكيميائية
الخلية الكهروكيميائية تأتي بصورتين رئيسيتين:
الخلية الجلفانية
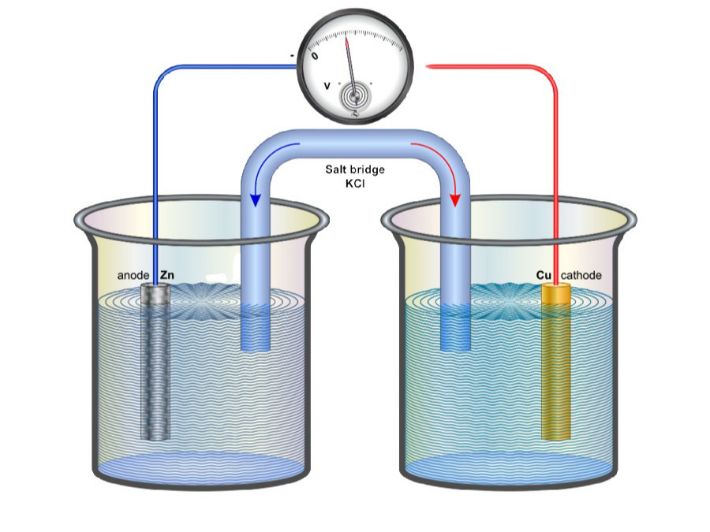
تحول الخلايا الجلفانية الطاقة الكيميائية إلى كهربائية من خلال تفاعلات الأكسدة والاختزال التي تجري في جزئين مختلفين من الخلية، كل جزء يحتوي على محلول يشتمل على أيونات حرة وموصل معدني يعمل كقطب. هذه الأقطاب تعرف باسم نصف الخلايا.
من الأمثلة البارزة على هذه الخلايا هي خلية دانييل، التي تستخدم فيها معادن الزنك والنحاس. يقوم الزنك بفقدان الإلكترونات (أكسدة) ليتحول إلى أيونات الزنك، بينما يكتسب النحاس الإلكترونات (اختزال) ويتحول من أيونات إلى نحاس صلب. سير هذه التفاعلات يؤدي إلى توليد الكهرباء في الخلية.
السلسلة الكهروكيميائية
السلسلة الكهروكيميائية تُعد ترتيباً للعناصر استناداً إلى قدرتها على الاختزال أو الأكسدة. يتم حساب هذا عن طريق مقارنة جهد كل قطب مع قطب الهيدروجين القياسي في ظروف محددة. تضم هذه السلسلة معادن وغير معادن، حيث يُظهر ترتيبهم مدى قدرتهم على اكتساب أو فقدان الإلكترونات. تعكس السلسلة الكهروكيميائية التفاعلية النسبية لهذه العناصر في العمليات الكيميائية.
خلية التحليل الكهربائي
تُستخدم خلية التحليل الكهربائي في تحويل الطاقة الكهربائية إلى طاقة كيميائية. تبدأ العملية بوضع أقطاب كهربائية داخل محلول يحتوي على أيونات موجبة وسالبة. عند تطبيق التيار الكهربائي، تتجه هذه الأيونات نحو الأقطاب ذات الشحنات المُعاكِسة، حيث تحدث عمليات الأكسدة والاختزال.
في مثال تحليل كلوريد الصوديوم المذاب، يُسخن المحلول حتى درجة حرارة تتجاوز 801 درجة مئوية، ثم يُضاف إليه قطبان كهربائيان. يُمرر التيار الكهربائي خلال المحلول، مما يُحفّز التفاعلات الكيميائية عند الأقطاب.
في هذه التفاعلات، ينتقل أيون الصوديوم نحو القطب السالب ويكسب إلكترونًا ليتحول إلى صوديوم معدني، بينما تنتقل أيونات الكلوريد إلى القطب الموجب وتفقد إلكترونًا لتتحول إلى غاز الكلور. النتيجة النهائية لهذه العملية هي تكوين صوديوم صلب وغاز الكلور من كلوريد الصوديوم.
أهمية الكيمياء الكهربائية
الكيمياء الكهربائية تلعب دورًا كبيرًا في فهم وتحليل ظواهر متنوعة منها تفاعل الأيونات وأساليب تنقية المعادن. إن لها دوراً أساسياً في تصنيع مواد كيميائية عديدة مثل هيدروكسيد الصوديوم والمواد المبيضة، التي تعتبر جزءاً لا يتجزأ من أنشطة الإنتاج الصناعي. الأجهزة الإلكترونية مثل الراديو وأجهزة التلفزيون وألعاب الأطفال، تعتمد في عملها على الطاقة المولدة عبر الخلايا الفولتية.
تسهم العمليات الكهروكيميائية في جمع بيانات قيمة تتعلق بالخصائص الكيميائية والطاقة المطلوبة لتفاعلات الأكسدة والاختزال. خلايا الوقود، التي تولد الطاقة المحولة إلى كهرباء، أساسية في عمل المركبات الفضائية. أخيرًا، أسهمت الأبحاث في مجال الكيمياء الكهربائية في دعم الدراسات البيوميدية وتحليل العمليات الكيميائية داخل الخلايا الحية.


